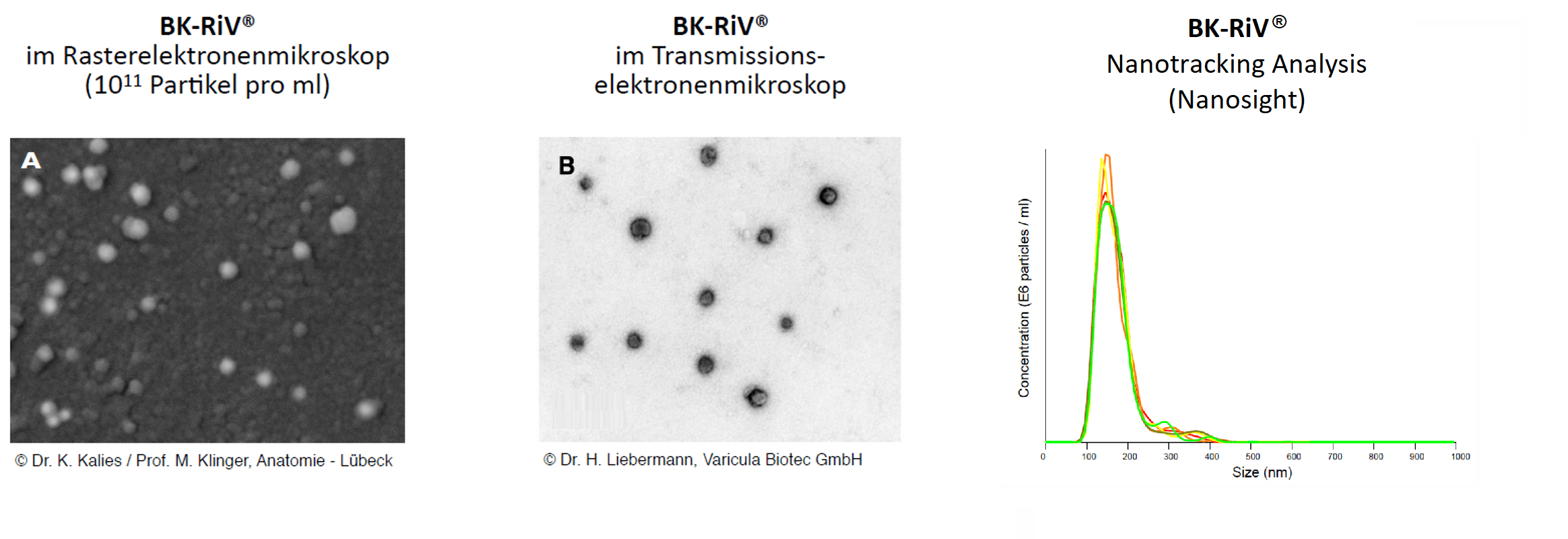
BK-RiV Herstellung
Die Entwicklung und Herstellung des BK-RiV-Wirkstoffes erfolgt in der GMP1 Reinraumanlage der Varicula Biotec GmbH in Wismar. Als Ausgangsmaterial dient eine umfassend dokumentierte und auf Virusfreiheit geprüfte Säugerzelllinie. Die Zellen werden einem spezifischen Stress ausgesetzt und mittels aufwendiger Trennverfahren werden die RiV-Partikel isoliert und aufgereinigt.
Das Herstellungsverfahren entspricht den GMP1-Anforderungen der Arzneimittelherstellung nach AMG2. Nach dem Ausbau einer eigenen Reinraumanlage in Wismar befinden wir uns in der Neubeantragung der Wirkstoffherstellungserlaubnis, nach deren Erteilung wir wieder über validierte und zertifizierte Herstellungs- und Prüfverfahren verfügen werden. Bei Interesse an weiteren Informationen und um mit der Varicula Biotec GmbH in Verbindung zu treten, benutzen Sie bitte eines der folgenden Kontaktformulare.
Fußnoten
- Unter GMP („Good Manufacturing Practice“) versteht man die „Gute Herstellungspraxis für Arzneimittel“. Die GMP-Regeln sind in nationalen und internationalen Regelwerken festgeschrieben. Als Schwerpunkte von GMP sind unter anderem die Anforderungen an die Hygiene, an die Räumlichkeiten, an die Ausrüstung, an Dokumentationen und Kontrollen zu nennen.
- Das deutsche Arzneimittelgesetz (AMG) ist ein Gesetz des besonderen Verwaltungsrechts und regelt den Verkehr mit Arzneimitteln im Interesse einer ordnungsgemäßen und sicheren Arzneimittelversorgung von Mensch und Tier. Inhaltlich steht es nah (supplementär) zum Betäubungsmittelgesetz.
